罕见疾病的新突破:发现三种罕见病未知的遗传原因
- 2023-03-22 18:00:35 健康一线
- 健康
据估算,全球受罕见病影响的有2.63亿至4.46亿人,但只有少数患者接受了基因诊断。在10,000种记录在案的罕见疾病中,只有不到一半具有已知的遗传原因。研究罕见疾病的遗传学机制是解决罕见疾病的重要途径之一。对大量罕见病患者进行基因组测序为发现仍未知的遗传原因提供了一条途径。
美国西奈山医院研究人员与来自英国布里斯托大学、比利时鲁汶大学、日本大学、美国马里兰大学、伦敦帝国学院等世界各地的同行合作,对罕见病基因进行了研究,并将相关结果发表在Nature Medicine上。此项研究发现了三种以前未知的罕见疾病的遗传原因,包括原发性淋巴水肿(组织肿胀)、胸主动脉瘤病和先天性耳聋。
在这项研究中,研究人员使用了一种新的计算方法来分析大型的基因数据集。他们使用了来自100,000人基因组计划(100KGP)的77,539个罕见病患者的数据。100KGP是一个包含有表型和全基因组测序的罕见病患者数据集;使用贝叶斯遗传关联方法BeviMed来推断基因与临床医生诊断参与者269种罕见疾病类别之间的关联,其中包括19个以前未被报道的关联;通过国际学术合作验证了三个最可信的新关联,并找到基因与罕见病之间的关系。
01原发性淋巴水肿
原发性淋巴水肿是一种罕见的疾病,其特征是淋巴管发育异常或功能障碍,导致淋巴液在组织中堆积,引起水肿和其他相关症状。ERG编码转录因子,这种转录因子在正常情况下对淋巴管发育和功能起着重要的调控作用。如果ERG发生功能丧失突变,则可能会影响淋巴管的正常发育和功能,导致淋巴液不能正常流动,从而引起原发性淋巴水肿。
BeviMed发现ERG基因中高影响突变与特定疾病“原发性淋巴水肿”具有显著的遗传关联。三个高PPA的变异负责该遗传关联,它们的位置范围从Ensembl转录本ENST00000288319.12的密码子182到463。其中一个患者的父母有两个无变异等位基因,表明该截短杂合变异是新生突变。第四个家庭的参与者在100KGP中注册时,因其他疾病而被收集数据,但在手动检查数据时,发现该参与者除了已知疾病特征外,还有与原发性淋巴水肿相关的特征,这提供了在探索队列中的内部验证。
先证者的父亲为嵌合体。ERG在淋巴内皮细胞核中的高表达水平,与淋巴管生成期间的转录调控功能相一致。此外,在原发性淋巴水肿病例中,缺陷的淋巴管生成可能是由于ERG的可用性减少(由于无义介导的降解或错误定位)而导致的。Erythroblast Transformation Specific(ETS)家族转录因子编码基因ERG的功能丧失突变导致原发性淋巴水肿。
图1 ERG中的功能丧失变异是原发性淋巴水肿的原因(图源:[1])
02Loeys-Dietz综合征
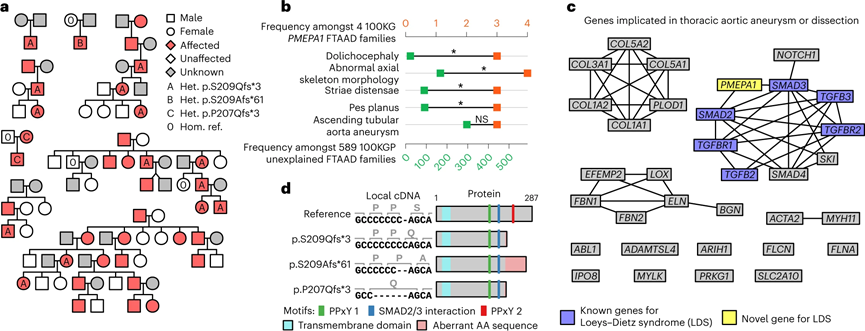
Loeys-Dietz综合征是一种罕见的遗传性疾病,其特征包括动脉瘤、动脉破裂、软骨发育异常等,这些症状可能会对患者的生命造成威胁。PMEPA1的高致病性突变与Familial thoracic aortic aneurysm disease(FTAAD)有关。在正常转录本ENST00000341744.8的最后一个外显子中,七个胞嘧啶的连续区间内有一个胞嘧啶插入的变异。该变异会引起一个p.S209Qfs3的移码,产生致病性最高的变异。
在100KGP队列中,在三个欧洲祖先的FTAAD谱系中观察到这个变异。这个关联在三个额外的病例集中得到了复制。首先,在日本患者群体中,有三个谱系的八名患者独立发现了相同的变异;其次,在100KGP Pilot Programme的另一个病例集中,发现了同一段多胞嘧啶区间内的单个胞嘧啶缺失变异,编码为p.S209Afs61。;最后,在比利时的一个家族中,受影响的成员携带了同一段多胞嘧啶区间的5个碱基缺失,引起了另外两个变异上游两个氨基酸的移码 (p.P207Qfs*3)。这些结果表明,PMEPA1基因最后一个外显子的截短突变会导致Loeys-Dietz综合征。
图2 PMEPA1中的截短变异导致Loeys-Dietz综合征(图源:[1])
03先天性听力障碍
隐性遗传性先天性听力障碍是一种常见的遗传性疾病,其特征是患者从出生时就存在听力障碍,这可能会影响语言和认知的发展。这种听力障碍通常是由遗传因素引起的,可以是由单个基因突变引起的单基因遗传,也可以是由多个基因突变和环境因素共同作用引起的复杂遗传。
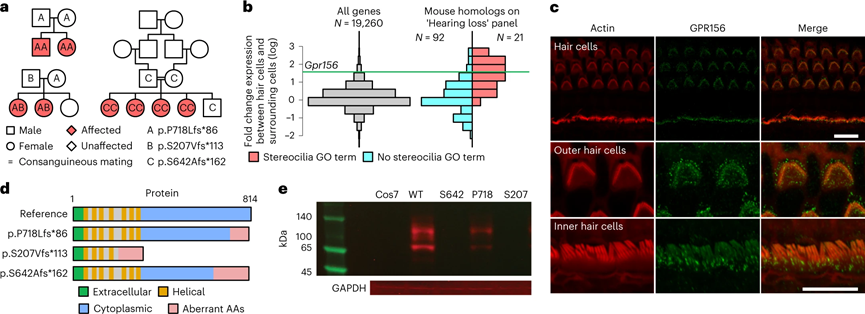
BeviMed确定了GPR156中高影响变异与特定疾病先天性听力障碍之间的隐性遗传关联。两个高影响力突变体是导致这种关联的原因。其中一个突变体是1bp插入变异(p.S207Vfs113);另一个突变体也是1bp插入变异(p.P718Lfs86)。在第一个家族中,有两个患者,均为该变异的纯合子,由杂合父母遗传。在第二个家族中,也有两个患者,这种情况下是由母系遗传相同的p.S207Vfs113变异和父系遗传不同的p.P718Lfs86变异所致的复合杂合子。使用GeneMatcher31,我们在沙特阿拉伯发现了一个含有两个致病性突变的家系,这两个突变预测p.S642Afs*162,均为GPR156的截短变异。在这三个家族中的八名患者均表现为先天性的非综合征性双侧感音神经性听力损失。
GPR156中的双等位基因链截短变体通过阻止GPR156蛋白的表达导致先天性听力损失,从而破坏听觉上皮细胞中的静纤毛形成。GPR156编码一种膜蛋白受体,这种受体在耳蜗和听神经中表达。如果GPR156发生功能丧失突变,就可能导致其编码的受体无法正常工作,从而影响耳蜗和听神经的正常发育和功能,最终导致隐性遗传性先天性听力障碍。
图3 GPR156中的功能缺失变异会导致隐性先天性听力损失(图源:[1])
此项研究通过对罕见疾病的基因分析,开发了一种轻量级且易于部署的关系型数据库Rareservoir,并使用BeviMed等方法对罕见疾病进行了基因分析。在统一分析中,发现了260种关联,其中241种在几十年的基因研究中已经发表过。这些关联涉及到86种疾病类别,包括多个器官系统。此外,还发现了19种未知的关联,其中三种涉及到之前未涉及的人类疾病相关基因。这些研究结果提供了一种可能性,即随着队列规模的扩大,统计推断的结果可能有助于指导临床报告过程。
艾卡恩医学院西奈山分校遗传和基因组科学副教授Ernest Turro博士说:“虽然罕见疾病的发生率很低,但总体而言,它们非常普遍。找到剩余的病因对于我们理解人类生物学以及开发诊断和治疗方法非常重要。许多患有罕见疾病的人们在多年的努力下才能获得遗传诊断。通过开发和应用统计方法和计算方法,寻找罕见疾病的新病因,我们希望扩大对这些疾病潜在病因的认识,缩短患者的诊断时间,并为治疗的开发铺平道路。”
本研究有几个局限性。首先,大约82%的100KGP参与者是欧洲血统,限制了识别其他血统群体特有的致病变异的能力。;其次,在分析的260个病例集中,28个包含少于5个先证者,限制了确定相应疾病类别的原因的能力,并突出了继续招募极罕见疾病患者的必要性;再者,研究只考虑了编码基因中的SNV和插入缺失。对非编码基因和基因组调控元件的结构变异和罕见变异的探索可能有助于进一步确定病因;此外,研究将注意力集中在罕见疾病的单基因模型上,但是某些罕见疾病的遗传病因可能是多基因的;最后,单基因疾病临床表现的重要变化可以用多基因效应来解释。这些局限性指向未来研究的多个有希望的途径,以揭示罕见疾病的剩余未知遗传决定因素。

本文地址:http://www.cnzhilian.com/jiankang/2023-03-22/633284.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 墨西哥中部一非法烟花厂爆炸致22人死伤2023-03-22 18:00:53
- 宁波最大冻品交易市场3月29日全面试营业2023-03-22 18:00:52
- 中消协对12大平台7类350家“第三方测评”监督:“无标准测评”“以商养测”等妨碍公平竞争引不满2023-03-22 18:00:51
- 五部门:做好享受税收优惠政策的集成电路企业等清单制定工作2023-03-22 18:00:50
- 驻蒙特利尔总领馆提醒领区华侨华人和留学生加强安全防范2023-03-22 18:00:48
-

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
2022-11-07
-

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
2022-09-08
-
烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
-
张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
-
目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
-
无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
-
2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30
文章排行榜
- 周排名
- 月排名
- 1艾尔建美学中国医美专家峰会聚焦“以求美者为中心” Going Beyond Beauty正式发布
- 2全国爱肝日,带你认识这几种累及肝脏的罕见病
- 3“中国医药企业研发指数”在京发布
- 4好梦中国科普公益行启动 以岭静神家族打响国人“健康睡眠”保卫战
- 5全球CRO普米尔医药与 InSilicoTrials Technologies 携手创建合成对照组优化罕见病疗法监管途径
- 6定了!第六届中源协和生命医学奖颁奖典礼暨高峰论坛与您相约北京
- 7春季肠胃不好怎么调理?太阳神猴头菇口服液助你有效护养肠胃!
- 8瑞思迈发布全球睡眠报告,呼吁大众提升睡眠健康意识
- 92023年苏州昆山社保缴纳基数标准是怎样的?
- 10家庭过期药回收立法:广药白云山家庭过期药品回收20周年公益活动在北京启动