Immunity:新研究揭示为何肺癌对免疫疗法反应不佳
- 2023-02-27 18:00:27 健康一线
- 健康
免疫疗法---刺激免疫系统攻击肿瘤的药物治疗---对某些类型的癌症有很好的效果,但它对肺癌的效果却好坏参半。
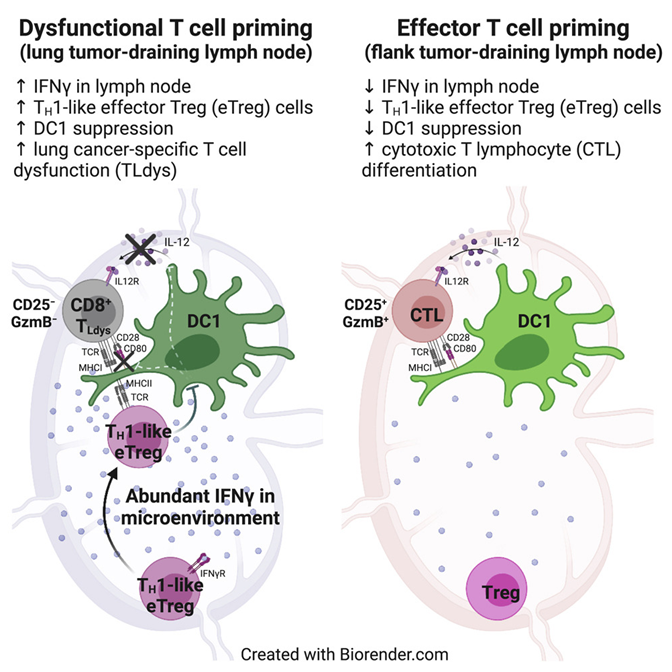
一项新的研究有助于阐明为何免疫系统对肺癌的反应如此乏力,即使是在用免疫治疗药物治疗之后。在这项针对小鼠的研究中,来自美国麻省理工学院的研究人员发现,在肺部自然发现的细菌有助于构建一种抑制肺部附近淋巴结中的T细胞激活的环境。他们在小鼠皮肤附近生长的肿瘤附近的淋巴结中没有发现那种免疫抑制环境。他们希望他们的发现可能有助于开发新的方法来提高对肺部肿瘤的免疫反应。相关研究结果发表在2023年2月14日的Immunity期刊上,论文标题为“Tissue-specific abundance of interferon-gamma drives regulatory T cells to restrain DC1-mediated priming of cytotoxic T cells against lung cancer”。
论文通讯作者、麻省理工学院科赫综合癌症研究所成员Stefani Spranger说,“在不同的淋巴结中启动的T细胞反应之间存在着功能差异。我们希望找到一种方法来抵消这种抑制性反应,以便我们能够重新激活靶向肺部肿瘤的T细胞。”
不能攻击
多年来,科学家们已知道,癌细胞可以发出免疫抑制信号,这导致了一种称为T细胞功能衰竭(T-cell exhaustion)的现象。癌症免疫疗法的目标是使这些T细胞恢复活力,以便它们能够再次开始攻击肿瘤。
一种常用于免疫疗法的药物涉及免疫检查点抑制剂,它能解除癌细胞对功能衰竭的T细胞的抑制并协助它们重新激活。这种方法对黑色素瘤等癌症的治疗效果很好,但对肺癌的治疗效果不佳。
Spranger近期的研究已对此提供了一种可能的解释:她发现一些T细胞甚至在到达肿瘤之前就已停止发挥作用了,因为它们在发育早期未能被激活。在2021年的一篇论文中,她确定了功能失调的T细胞群体,这些功能失调的T细胞可以通过一种使它们在进入肿瘤后无法攻击癌细胞的基因表达模式与正常T细胞区分开来。
Spranger说,“尽管这些T细胞能够增殖,而且它们渗透到肿瘤中,但它们从未被允许杀死癌细胞。”
在这项新的研究中,她的团队进一步深入研究了这种发生在淋巴结中的激活失败,而淋巴结过滤从附近组织排出的液体。淋巴结是“杀伤性T细胞”遇到树突细胞的地方,树突细胞呈递抗原(肿瘤蛋白)并帮助激活这些T细胞。
图片来自Immunity, 2023, doi:10.1016/j.immuni.2023.01.010。
为了探索为什么一些杀伤性T细胞不能被正确激活,Spranger团队研究了在肺部或侧腹植入肿瘤的小鼠。所有的肿瘤在基因上都是相同的。
这些作者发现,从肺部肿瘤排出的淋巴结中的T细胞确实遇到了树突细胞,并识别这些细胞呈递的肿瘤抗原。然而,这些T细胞未能被完全激活,这是由于受到另一种称为调节性T细胞的T细胞群体的抑制。
他们发现,这些调节性T细胞在从肺部排出的淋巴结中受到强烈激活,但在位于侧腹的肿瘤附近的淋巴结中却没有。调节性T细胞通常负责确保免疫系统不攻击人体自身的细胞。然而,他们发现,调节性T细胞也干扰了树突细胞激活靶向肺部肿瘤的杀伤性T细胞的能力。他们还发现了这些调节性T细胞如何抑制树突细胞:通过从树突细胞表面去除刺激性蛋白,从而阻止它们激活杀伤性T细胞。
微生物的影响
进一步的研究显示调节性T细胞的激活是由从肺部排出的淋巴结中高水平的γ干扰素所驱动。这种信号分子是在对共生菌---通常生活在肺部中而不引起感染的细菌---的存在作出反应时产生的。
这些作者尚未确定诱发这种反应的细菌类型或产生干扰素γ的细胞,但是他们发现,当他们用一种阻断干扰素γ的抗体治疗小鼠时,他们可以恢复杀伤性T细胞的活性。
Spranger说,γ干扰素对免疫信号有多种影响,阻断它可以抑制针对肿瘤的整体免疫反应,因此用它来刺激杀伤性T细胞将不是一种用于患者的好策略。她的实验室如今正在探索其他帮助刺激杀伤性T细胞反应的方法,如对抑制杀伤性T细胞反应的调节性T细胞进行抑制,或者一旦识别出共生菌,就阻断它们发出的信号。(生物谷 Bioon.com)
参考资料:
Maria Zagorulya et al. Tissue-specific abundance of interferon-gamma drives regulatory T cells to restrain DC1-mediated priming of cytotoxic T cells against lung cancer. Immunity, 2023, doi:10.1016/j.immuni.2023.01.010.

本文地址:http://www.cnzhilian.com/jiankang/2023-02-27/629353.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- AI造物里程碑:人类首次从头设计全新荧光素酶,转化公司已完成2500万美元融资2023-02-27 18:00:30
- 苏州大学陈倩/刘庄团队通过调节肥胖相关肿瘤微环境,提高癌症免疫治疗效果2023-02-27 18:00:30
- Cancer Res: ROR2可能为前列腺癌潜在的生物标志物2023-02-27 18:00:29
- 英国药理学:丙氨酰内酯作为天然NLRP3抑制剂缓解小鼠NLRP3驱动的炎性疾病2023-02-27 18:00:29
- 关节炎有望被攻克!科学家揭示了驱动炎性关节炎的关键信号2023-02-27 18:00:28
-

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
2022-11-07
-

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
2022-09-08
-
烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
-
张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
-
目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
-
无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
-
2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30