《自然·神经科学》:小胶质细胞为何会吃掉阿尔茨海默病患者的神经突触?科学家首次揭示背后机制
- 2023-02-24 18:00:18 健康一线
- 健康
近些年来,越来越多的研究指出,在阿尔茨海默病(AD)患者尚未出现症状的临床前期,已经出现小胶质细胞吞噬作用,即使功能正常的神经元突触也会被小胶质细胞吞噬,这一过程被称作突触变性[1]。
虽然许多研究已经证明了多种分子参与这一过程,但小胶质细胞吞噬突触的诱因,以及如何抑制这一过程,仍有许多未解之谜。
近期,来自伦敦大学学院Soyon Hong教授及其团队,在《自然·神经科学》上发表了最新成果[2]。
他们首次证实,AD小鼠模型中的血管周围巨噬细胞(PVM)和血管周围成纤维细胞(PVF)会释放分泌型磷酸蛋白1(SPP1),随后SPP1会诱导脑实质中的小胶质细胞吞噬神经元突触。敲除AD小鼠模型的SPP1基因后,小胶质细胞吞噬突触的活动被有效抑制。
这个研究首次发现了SPP1在血管周围细胞和小胶质细胞之间的桥梁作用,并证实了这一分子在AD进程中促进突触变性的重要角色,为调控AD发病过程中突触变性引入全新靶点,也为抑制AD早期引起的神经系统损伤带来希望。
论文标题截图
通过敲入携带致病性突变NL和F的人源性淀粉样前体蛋白(APP)基因,Hong教授团队首先构建了APPNL-F小鼠模型(NLF)。
这一模型的Aβ初始水平与野生型小鼠(WT)相同,此后Aβ在特定细胞和特定时间内的表达增加,且能有效避免APP过度表达引起的神经毒性,目前在AD的研究中应用较为广泛。
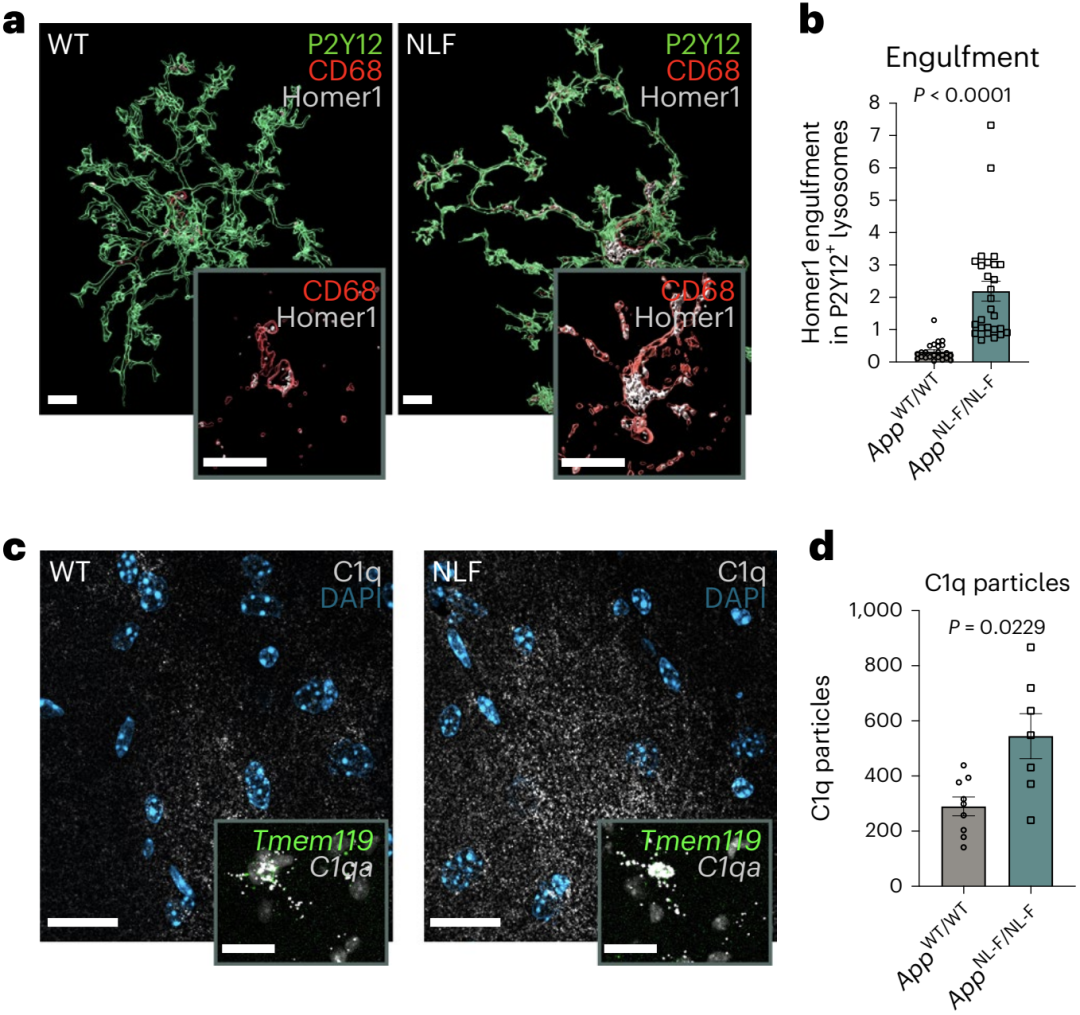
Hong团队对比了6个月的NLF和WT小鼠的小胶质细胞吞噬突触情况。结果发现在海马CA1区小胶质细胞特异的溶酶体(CD68阳性P2Y12阳性)中,NLF内Homer1标记的突触数量约为WT的8倍(图1a,b),这预示着NLF小鼠的小胶质细胞胞体内突触数量非常高。
鉴于补体激活经典途径中的启动因子C1q,与神经系统中局部小胶质细胞的吞噬活动相关,因此他们也发现在NLF中C1q颗粒的数量显著升高,且在小胶质细胞(Tmem119阳性)中含量上升(图1c,d)。
这两个实验结果证实,小胶质细胞吞噬突触的行为在AD模型中更加活跃。
图1:NLF和WT小鼠小胶质细胞吞噬突触的情况
之前有研究指出,外周的巨噬细胞在接受到炎症因子刺激后能够分泌SPP1,之后SPP1协助巨噬细胞完成吞噬病原的过程[3]。
那么SPP1是否在神经系统中扮演着同样的角色,与小胶质细胞——中枢神经系统的巨噬细胞——吞噬突触的过程有关?
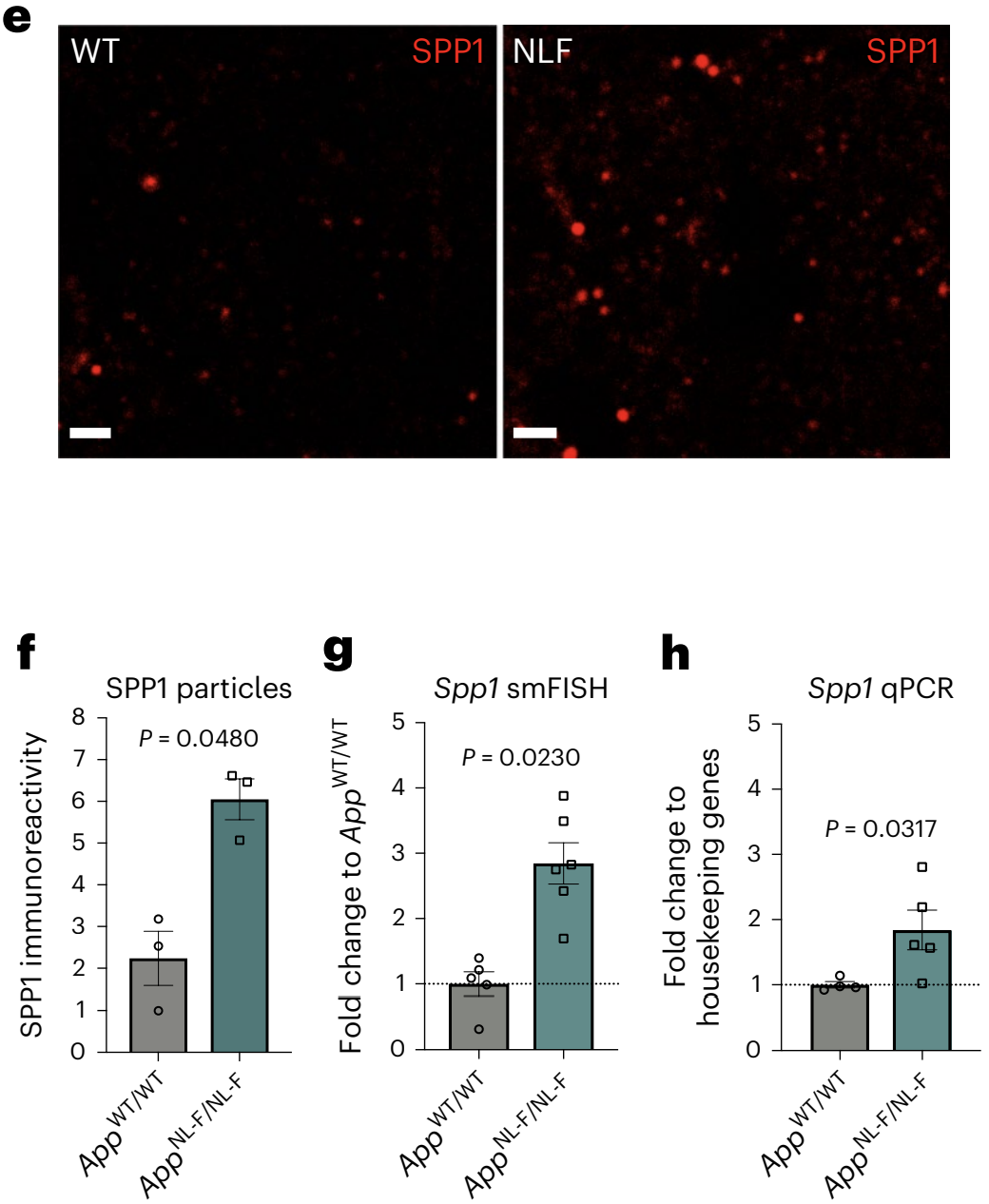
为了回答这个问题,Hong团队通过3D成像技术观察了两组小鼠的海马CA1区,发现NLF组SPP1颗粒的数量较对照组增加了3倍(图2e,f)。这一结果被单分子荧光原位杂交(smFISH)和qPCR进一步被证实(图2g,h)。
图2:NLF和WT小鼠中Spp1表达水平的情况
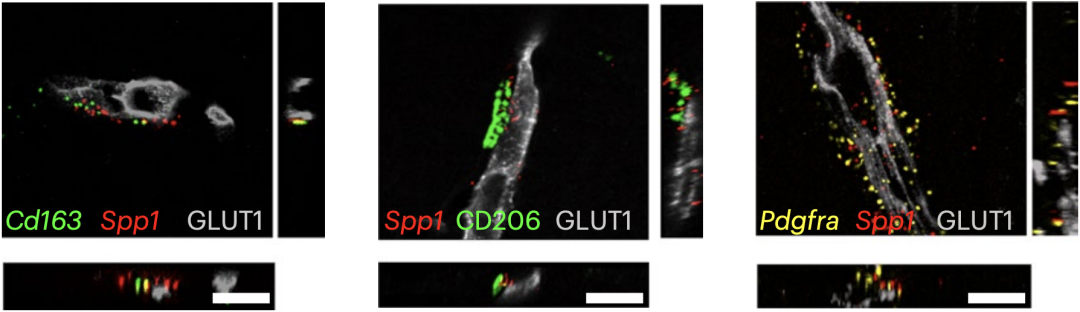
之后,Hong团队采用3D重建技术对SPP1进行定位,发现在NLF小鼠中SPP1的分布与葡萄糖转运蛋白1(GLUT1)阳性的血管关系密切。在AD患者的尸检标本中,他们观察到了同样的结果。
这说明,表达Spp1基因的细胞应该在血管周围。他们最终将目标锁定在血管周围巨噬细胞(PVM,Cd163阳性,CD206阳性)和血管周围成纤维细胞(PVF,Pdgfra阳性)上(图3),电镜实验进一步证实了上述发现。
图3:Spp1表达位置的位于血管周围
接下来,Hong团队想知道NLF中SPP1升高与小胶质细胞吞噬突触增加之间是否存在因果关联。
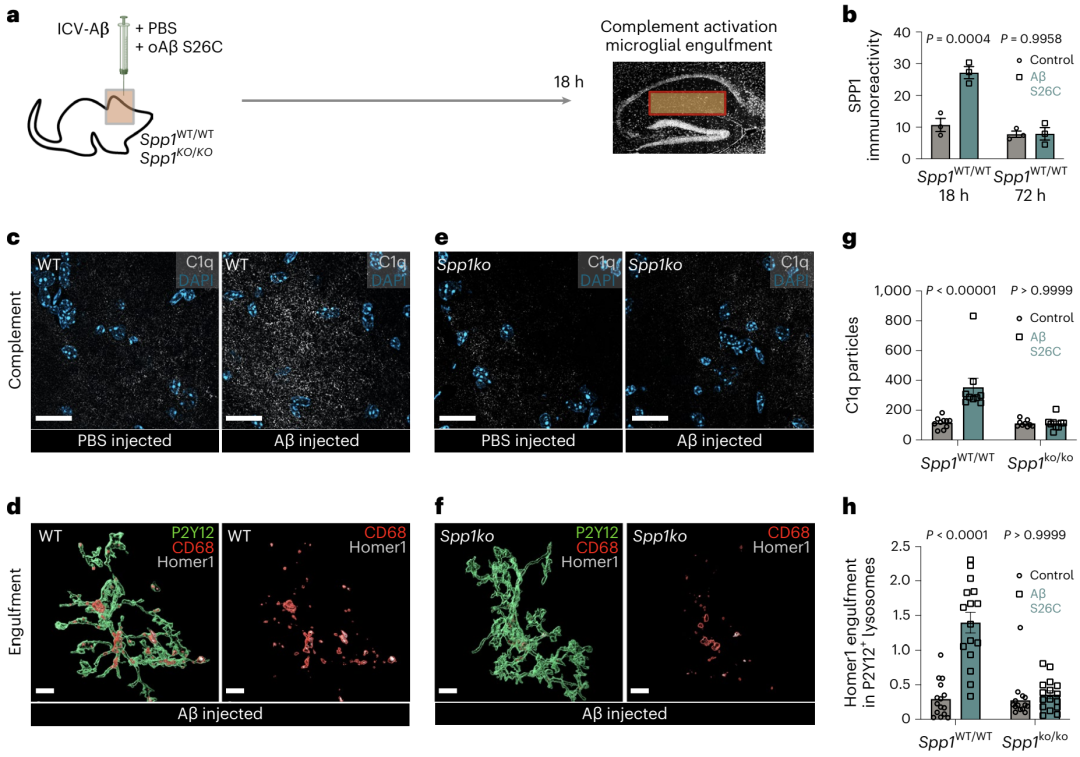
他们首先构建了Spp1基因敲除小鼠模型Spp1KO/KO(Spp1 KO),并在小鼠脑室内注射Aβ寡聚体(oAβ),观察是否能诱发小胶质细胞吞噬突触的过程。
结果发现,Spp1 KO的小鼠中C1q颗粒数量和小胶质细胞溶酶体内的突触数量,与注射过oAβ的WT小鼠相比显著降低,与注射PBS的Spp1 KO小鼠内小胶质细胞吞噬突触的数量无显著差异(图4)。
图4:实验方法以及C1q和突触变性在各种动物模型的情况对比
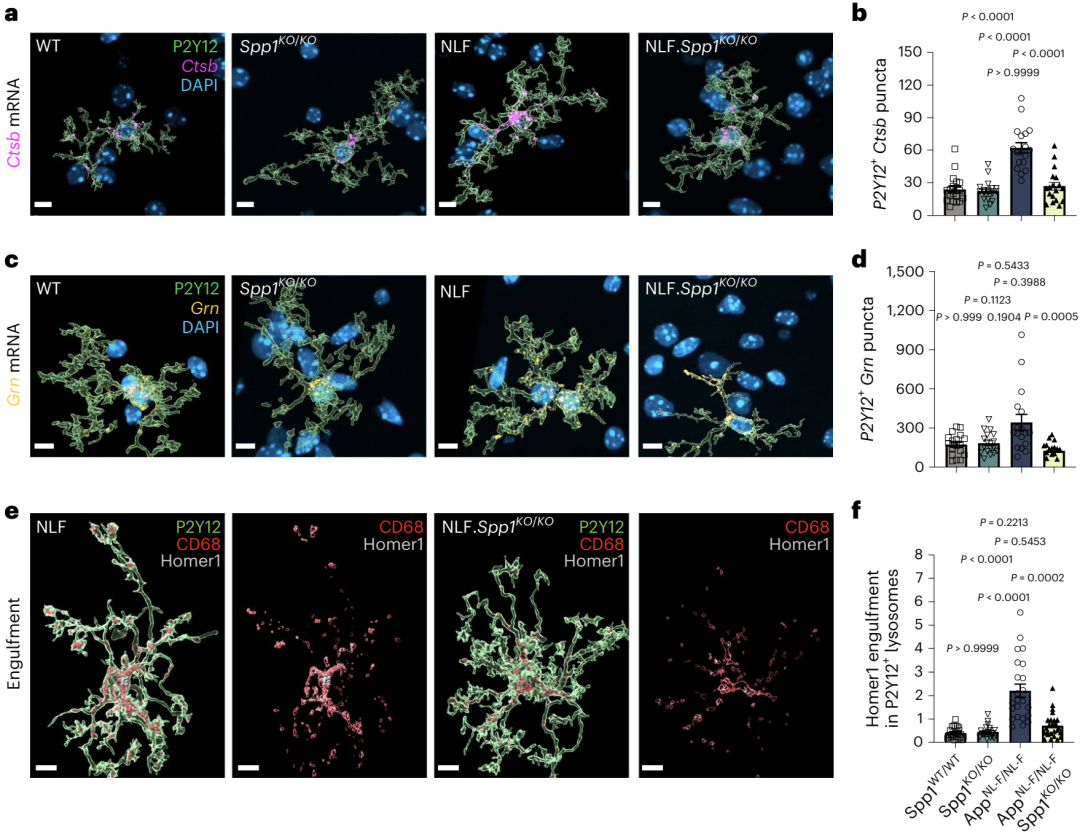
随后,Hong团队让NLF小鼠模型与Spp1 KO小鼠模型杂交,获得了Spp1被敲除的AD小鼠模型(APPNL-F·Spp1KO/KO)。
通过比较APPNL-F·Spp1KO/KO和NLF小鼠,他们发现,在APPNL-F·Spp1KO/KO小鼠中,小胶质细胞内溶酶体相关蛋白的基因表达(Grn和Ctsb),以及小胶质细胞内吞噬的突触数量,明显低于Spp1表达正常的AD小鼠(图5)。
以上实验结果说明,SPP1是AD小鼠模型突触变性的重要驱动因子。
图5:Spp1 KO抑制AD模型中突触变性的情况
最后,基于单细胞RNA测序数据,他们推定血管周围的SPP1在AD小鼠模型的海马区诱导小胶质细胞吞噬状态。
总的来说,Hong团队证实了AD或者外源性oAβ可以促使血管周围的PVM和PVF分泌SPP1,且SPP1能够诱导脑实质中的小胶质细胞吞噬突触,在AD模型中造成突触变性,而敲除Spp1基因能够有效抑制小胶质细胞吞噬引起的突触变性过程,减轻神经系统损伤。
小胶质细胞吞噬突触这一过程不仅在AD中活跃,在其他神经和精神系统疾病中也高于正常水平。因此,本研究的意义将来可能会扩展到更广泛的疾病模型研究中,为AD等神经退行性疾病带来新的干预或治疗靶点。
参考文献:
1.Tzioras, M., McGeachan, R.I., Durrant, C.S. et al. Synaptic degeneration in Alzheimer disease. Nat Rev Neurol 19, 19–38 (2023).
2.De Schepper, S., Ge, J.Z., Crowley, G. et al. Perivascular cells induce microglial phagocytic states and synaptic engulfment via SPP1 in mouse models of Alzheimer’s disease. Nat Neurosci (2023).
3.Rittling SR. Osteopontin in macrophage function. Expert Rev Mol Med (2011).

本文地址:http://www.cnzhilian.com/jiankang/2023-02-24/628873.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 内蒙古煤矿坍塌事故调整救援方案 避免发生次生灾害影响2023-02-24 18:00:20
- 中央气象台:弱冷空气将影响华北东北2023-02-24 18:00:20
- 文化和旅游部:深化高校共建助推文化和旅游高质量发展2023-02-24 18:00:20
- 本轮疫情是否已经结束?官方最新研判2023-02-24 18:00:20
- 港深联合发布十六条措施促进跨境知识产权合作2023-02-24 18:00:20
-

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
2022-11-07
-

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
2022-09-08
-
烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
-
张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
-
目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
-
无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
-
2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30