药品安全形势平稳可控 质量持续保持较高水平
- 2023-04-23 11:02:15
- 产业
 |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
2022年是实施“十四五”规划的关键之年。国家药监局认真贯彻落实“四个最严”要求,以守底线保安全、追高线促发展为基本任务,坚持人民至上,保障用药安全有效,慎终如始助力保障疫情防控大局,组织各省(区、市)药品监管部门与相关检验机构在全国范围内对部分生产、经营、使用环节的药品质量开展抽查检验工作,评估上市后药品的质量状况,打击制售假劣药品行为,通过持续完善药品抽检管理体系,不断创新监管制度机制和方式方法,协同高效做好新形势下的药品抽检工作。2022年国家药品抽检结果显示,当前我国药品安全形势总体平稳可控,药品质量持续保持在较高水平。
一、概述
药品抽检作为药品监管的重要技术支撑,是发现药品质量风险、消除药品质量隐患、持续提升药品质量的重要手段,是有效打击假冒伪劣药品、保障公众用药安全的重要举措。
2022年,为贯彻落实《中华人民共和国药品管理法》和《中华人民共和国疫苗管理法》,国家药监局根据《药品质量抽查检验管理办法》等有关要求,以问题为导向,以风险防控为目标,采取“分散抽样、集中检验、探索研究、综合评价”的抽检模式,统筹组织全国31个省(区、市)和新疆生产建设兵团遵循分级抽样模式抽取样品;由中国食品药品检定研究院(以下简称中检院)等47个承检机构负责检验样品,构建以问题为导向的药品质量研究评价体系,揭示可能存在的质量安全隐患,完善风险分级防控机制,对发现的问题随时报告、随时研判、随时处置。另外,通过优化药品抽检模式,创新“互联网+监管”智慧监管手段,如开发启用“国家药品抽检信息系统”APP抽样模块,实现手机在线抽样功能;首次对网络销售药品开展抽样,探寻线下线上不同来源药品是否存在质量差异;保持加大中药材质量监测力度等监管策略,进一步提升抽检服务监管效能。
2022年,国家药品抽检共完成134个品种17060批次制剂产品与中药饮片的抽检任务,样品来源涉及3495家药品生产、经营和使用单位。对检出的107批次不符合规定产品,国家药监局组织各省(区、市)和新疆生产建设兵团药品监管部门,及时采取相应的风险控制措施,通过科学分析研判确定风险点,对涉事企业和单位依法进行查处,对个别企业存在违法违规生产、质量管理水平较低、药品质量保障体系存在缺陷等问题,依风险等级分别开展有因检查、风险提示、督促整改等相应的监管措施。通过对不合格产品查控和信息公开以及对风险线索核查处置,对药品从业主体形成强烈震慑,使其强化药品全生命周期和全过程质量控制意识。
二、抽检数据分析
(一)抽样情况
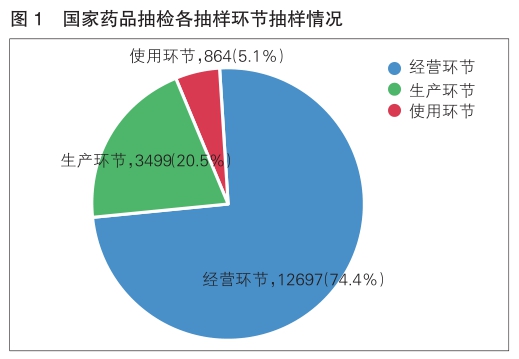
2022年,国家药品抽检共抽取制剂产品与中药饮片品种134个,包括化学药品73个、中成药47个、中药饮片9个、生物制品5个,其中国家基本药物品种47个;共抽检样品17060批次,包括生产环节3499批次、经营环节12697批次(包含互联网环节51批次)、使用环节864批次(详见图1),涉及977家药品生产企业、2184家药品经营企业和334家药品使用单位。
(二)药品制剂抽检数据分析
2022年,国家药品抽检共抽检制剂产品15385批次。经检验,15332批次产品符合规定,53批次产品不符合规定。抽检的125个品种中,全部样品符合规定的制剂品种有108个,共13029批次。其中,化学药品有68个品种8750批次,中成药有35个品种4112批次,生物制品有5个品种167批次。
1.化学药品
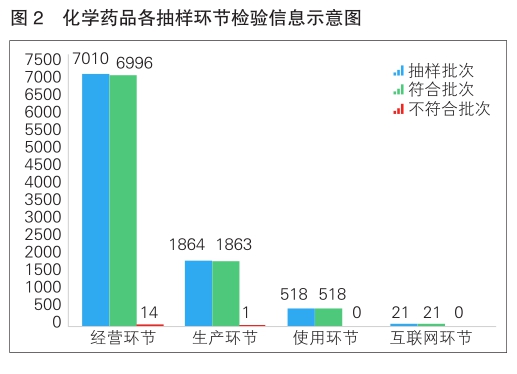
2022年,国家药品抽检共抽检化学药品73个品种(化学药49个、抗菌药14个、生化药10个)9413批次,涉及生产环节1864批次、经营环节7010批次、使用环节518批次、互联网环节21批次。经检验,共有15批次产品不符合规定,在生产、经营环节分别检出不合格产品1批次和14批次,占对应环节全部样品的0.1%、0.2%;在使用环节、互联网环节未检出不符合规定产品(详见图2)。
2022年,国家药品抽检化学药品共涉及15个剂型,有4个剂型存在不符合规定产品。其中,注射剂(9批次)、胶囊剂(3批次)、凝胶剂(2批次)、颗粒剂(1批次),分别占对应剂型全部产品的0.3%、0.2%、1.1%和0.2%。
不符合规定项目包括检查和含量测定,不符合规定产品数量依次为11批次、4批次,分别占全部不符合规定项目的73.3%和26.7%。
抽检结果提示,生产企业应对原辅料和包装材料进行严格把关,优化生产工艺管理与关键质量参数控制,重点关注灭菌工艺、原辅料投料量、分装的稳定性,提高生产工艺稳定性;经营企业应加强药品储存、运输过程管理,提升温湿度控制水平,重点关注需要阴凉、冷藏储存等特殊条件保存的药品;建议监管部门严格审查企业批生产记录,核查原辅料投料量,推动质量标准提升。
2.中成药
2022年,国家药品抽检共抽检中成药47个品种5805批次,涉及11个剂型,在生产、经营、使用、互联网环节各抽取样品826批次、4917批次、32批次、30批次。经检验,符合规定5767批次,不符合规定38批次(含4批次补充检验检出高于限量值的灰毡毛忍冬皂苷乙),生产环节和经营环节分别检出不符合规定产品4批次和34批次,占对应环节全部样品的0.5%和0.7%。
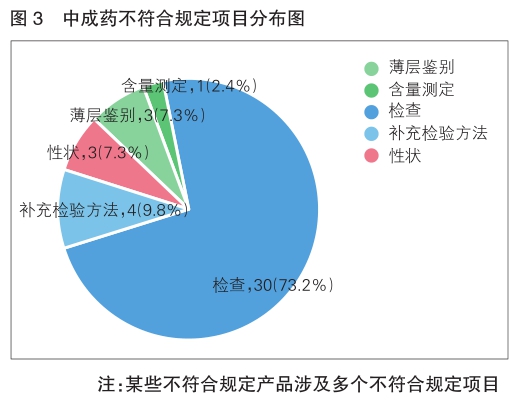
不符合规定项目主要涉及检查、补充检验方法、性状、鉴别、含量测定项等,不符合规定产品数量依次为30、4、3、3和1批次,分别占全部不符合规定项目的73.2%、9.8%、7.3%、7.3%和2.4%(详见图3)。
不符合规定产品主要涉及7个剂型,其中丸剂(19批次)、酊剂(5批次)、胶囊剂(4批次)、合剂(4批次)、颗粒剂(3批次)、糖浆剂(2批次)和片剂(1批次),分别占对应剂型全部样品的1.3%、2.6%、0.4%、1.1%、0.3%、0.8%和0.1%。
抽检结果提示,生产企业应加强内部质量控制,提高生产管理水平,从源头把控药材质量,严格投料药材入厂检验,优化生产关键质量参数控制,重点关注产品分装与灭菌工艺;经营企业应完善药品运输、储存过程管理,避免产品受损;建议监管部门加强对生产企业的监督检查,督促其严格按照处方工艺投料,严格执行GMP规范,从而保证中成药的质量及疗效。
3.生物制品
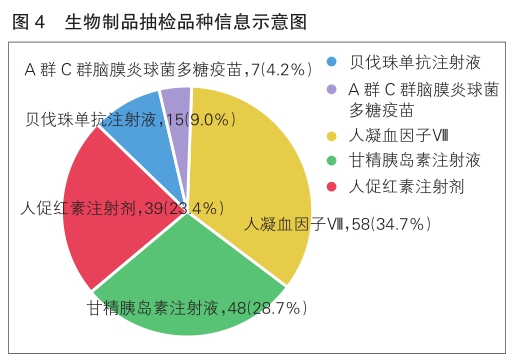
2022年,国家药品抽检共抽检生物制品5个品种167批次,其中生产、经营、使用环节分别抽取52批次、86批次、29批次;涉及治疗类品种4个、预防类品种1个;剂型均为注射剂(详见图4)。经检验,所检项目均符合规定,合格率为100%。
4.国家基本药物
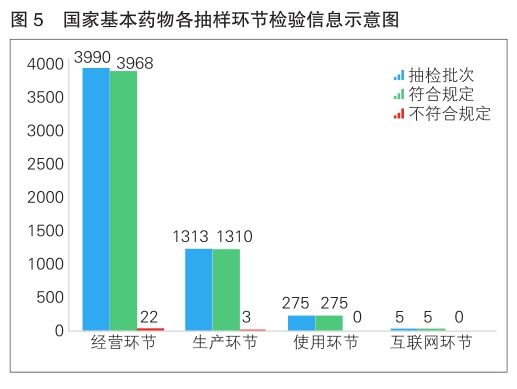
2022年,国家药品抽检共抽检基本药物(不含中药饮片)38个品种5583批次,在生产、经营、使用、互联网环节各抽取样品1313批次、3990批次、275批次、5批次。经检验,不符合规定25批次,分别在生产与经营环节检出不符合规定产品3批次和22批次,涉及4个剂型。抽检结果显示,国家基本药物整体质量状况较好(详见图5)。
5.国家药品集中采购中选品种
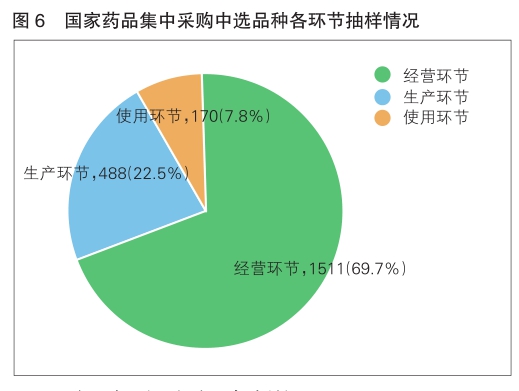
2022年,国家药品抽检共抽检药品集中采购中选品种16个品种2169批次,在生产、经营、使用环节各抽取样品488批次、1511批次、170批次。经检验,所检项目均符合规定,合格率为100%。抽检结果显示,国家药品集中采购中选品种整体质量状况较好(详见图6)。
6.进口药品(不含进口中药材)
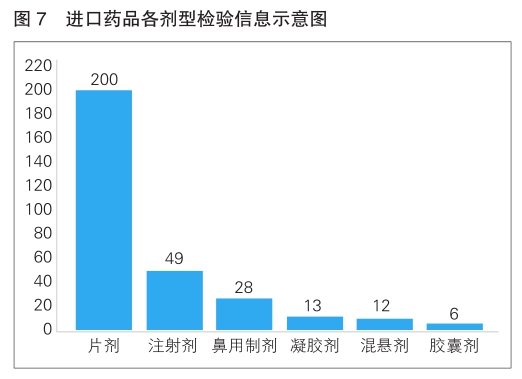
2022年,国家药品抽检共抽检进口药品308批次,涉及6个剂型(详见图7),其中生产环节8批次、经营环节263批次、使用环节37批次。经检验,所检项目均符合规定,合格率为100%。
(三)中药饮片专项抽检及中药材质量监测情况
2022年,国家药监局继续组织开展中药饮片专项抽检。全年共抽检9个中药饮片品种1675批次(其中中药配方颗粒18批次,中药饮片1657批次),重点针对可能存在的染色、增重、掺伪或掺假、不规范种植等质量问题开展检验和探索性研究。经检验,符合规定1621批次,不符合规定54批次。
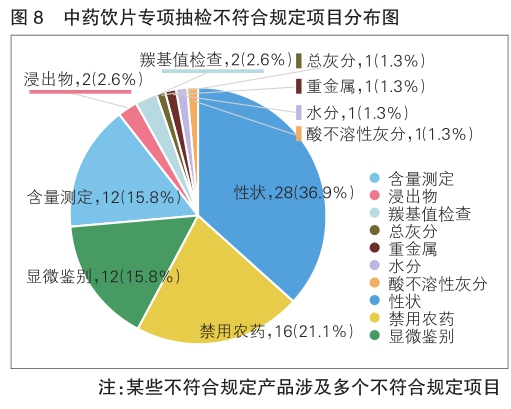
不符合规定项目主要涉及性状(28批次)、禁用农药(16批次)、显微鉴别(12批次)、含量测定(12批次)、羰基值检查(2批次)、浸出物(2批次)、水分(1批次)、总灰分(1批次)、酸不溶性灰分(1批次)、重金属(1批次)等,分别占全部不符合规定项目的36.9%、21.1%、15.8%、15.8%、2.6%、2.6%、1.3%、1.3%、1.3%、1.3%(详见图8)。
同时,为贯彻落实《中华人民共和国中医药法》有关要求,国家药监局继续组织开展中药材质量监测,组织对部分药品生产企业、药材市场集散地或种植集中区的中药材质量进行监测。2022年中药材质量监测共抽取9个品种241批次样品,其中药品生产企业187批次,市场集散地或种植集中区54批次。所有样品按照不同品种特点,针对相应项目进行了研究性检验,主要针对掺杂掺伪、加工炮制规范、农药残留等问题开展。
2022年中药饮片专项抽检及中药材质量监测发现的主要问题有:一是混伪品掺伪问题,如片姜黄存在蓬莪术掺伪、山银花掺伪金银花、麻牛膝掺伪川牛膝、紫草饮片存在同属与近源属植物混用问题;二是掺杂问题,如茜草中掺入较多地上茎导致性状、显微鉴别、浸出物不符合规定;三是外源性有害物质残留超限问题,部分中药饮片存在农药残留、重金属及有害元素超标等隐患,如部分批次菊花禁用农药超标、个别批次金银花重金属超标、部分批次川牛膝重金属超出通则限量规定等;四是采收加工与加工炮制不规范问题,如不同采收期金银花样品质量差异较大,川牛膝干燥过程中未按药典规定进行发汗且存在产地趁鲜加工现象。
抽检及监测结果提示,我国中药材及中药饮片总体质量状况良好。中药饮片全产业链参与者应进一步增强质量意识和责任意识,生产企业应提升全程质量控制意识,严格遵照质量标准及炮制规范要求执行;从源头保障原料药材的质量,重视中药材的道地性种植及规范生产,对药材采收后、饮片炮制加工前的药材供货商环节的质量把控,重点关注掺伪、有害物质残留等问题;加强药材溯源管理及贮存环节管理,督促药品上市许可持有人严格工艺规程与购进药材质量控制;继续强化中药材市场监测。
(四)探索性研究
探索性研究在识别掺杂使假、打击违法违规生产、提升国家药品标准等方面发挥了重要作用,也为推动企业药品质量后续技术研究提供了更加专属的方法和参考。2022年,各药品检验机构按照法定药品标准方法与探索性研究方法检验并重原则,全面考察药品的安全性、有效性及现行标准的可行性,同时探寻潜在风险,为提升药品质量标准、提高监督管理水平提供科学可靠的技术依据。发现的主要问题有:
一是中药饮片混用掺伪问题,使用伪品、掺伪的中药材及饮片生产中药制剂的问题仍然存在;二是个别企业违法违规生产问题仍然存在,如擅自改变生产工艺,低限或使用掺伪、替代品投料,违反关键工艺制法,擅自改变或添加辅料、防腐剂和抑菌剂等;三是不同厂家使用的原料药质量存在差异,部分制剂的质量差异值得进一步研究比较;四是外源性有害物质超限,部分品种重金属、农药、防腐剂残留量超限;五是包装材料相容性问题影响产品质量稳定性。
三、抽检结果应用
药品抽检作为药品监管的重要手段,在发现药品质量风险、打击违法违规行为中发挥着不可替代的重要作用,是实现科学监管、严格监管的重要技术支撑。国家药品抽检的目的不仅是把控风险、规范生产和保障药品质量安全,其成果的积极运用更是持续提升药品质量、推动产业提质升级的重要途径。
(一)创新抽检模式,探索智慧监管
为了不断推进药品抽检制度体系现代化,健全完善药品抽检模式,2022年运用“互联网+监管”的智慧监管手段,优化创新抽样模式,如启用“国家药品抽检信息系统”APP抽样功能,实现手机录入操作,进一步优化在线抽样功能,发挥抽检工作数字化优势,一定程度上解决了抽样人员携带抽样设备、抽样单位公章过于繁琐等问题;首次对网络销售药品开展抽样,旨在探寻线下线上不同来源药品是否存在质量差异;关注历年风险品种,通过持续加大中药材质量监测力度等监管策略,进一步提升抽检服务监管效能。
(二)聚焦社会热点,开展专项监测
近年来,药品安全突发事件是公众和媒体关注的焦点,随着检测分析技术的日新月异,一些已上市成熟药品中未曾暴露的质量安全性问题被逐渐揭示。例如,国家药监局聚焦社会热点和监管中出现的新问题,针对个别化学药品中可能含有基因毒性杂质的潜在风险,2022年继续设立研究专项,对雷尼替丁等5个品种开展专项抽检,持续加强同类型或相似潜在风险的监测和隐患排查,对相关科学问题开展深度研究,对发现的超限产品及时采取召回等控制措施,并要求将其纳入地方药品抽检开展跟踪抽检,确保整改到位。多年来,监管部门、技术机构、持有人等各方依职责采取建立方法、自查自检、技术指导、监督抽检、风险控制等措施,使化学药品中基因毒性杂质问题得到有效控制。
(三)深入排查风险,查控假劣药品
2022年,国家药监局依照“风险控制-依法处置-排查原因并整改-信息公开”的监管模式,确保风险消除,警示用药安全。组织各省级药品监管部门对国家药品抽检发现的107批次不符合规定产品,在第一时间采取查封扣押、暂停销售使用、要求企业主动召回等风险控制措施;对涉及的相关企业和单位均依法组织查处;要求药品生产企业认真排查,督促其查找问题原因并切实整改,确保质量安全隐患得到及时有效清除。通过药品抽检严厉打击了制售假劣药品行为,发挥了震慑不法企业、净化市场环境的作用。此外,国家药监局在2022年共发布药品补充检验方法5个,为打击隐蔽性极强的掺杂掺假等违法行为提供了监管利器,也为企业保障药品质量安全提供了科学依据。
(四)加大风险提示,落实主体责任
对探索性研究中发现的有关生产工艺、处方、原辅料、包装材料、说明书等方面可能存在的一般性问题,药品监管部门通过“药品质量提示函”等形式反馈相关企业,提升企业的质量意识,加强企业主体责任的落实。
例如,通过探索性研究发现部分批次布地奈德吸入气雾剂采用乙醇为溶剂的溶液体系存在包材相容性问题,且抗氧剂消耗过快无法在有效期内持续发挥抗氧化作用,提示其处方设计存在缺陷;小儿感冒颗粒探索性研究发现,部分批次石膏中钙含量远低于拟定的限度值,石膏显微特征难见,提示生产企业未按照制剂工艺进行原粉投料。企业就风险提示开展排查、分析和验证,采取优化生产工艺、提高内控标准、加强原辅包质量控制等整改措施,提升产品质量水平。
(五)深化信息公开,构建共治格局
国家药监局继续以通告的形式,依法及时向公众警示不符合规定药品抽检信息,筑牢公众用药安全防线。2022年共发布药品质量通告6期,在震慑不法企业的同时,提升了药品监管的权威性和政府公信力。中检院持续在官方网站公开国家药品抽检的探索性研究情况,2022年共发布159个品种的新建检验方法,通过信息的共享利用,进一步增强持有人的质量安全意识和主体责任自律意识,促进产品研发创新升级。
2022年12月,“中国药品质量安全年会”作为行业内获取药品质量提升信息的重要渠道之一,以线上形式召开。该年会努力通过搭建检验检测、生产研发机构信息交流平台,通报药品抽检结果,分析药品质量状况,挖掘质量安全问题,助推药品产业提质升级,全面构建政府监管、行业自律、企业自治、社会监督的共治格局。
(报告来源:中检院网站,标题为编者所加)

本文地址:http://www.cnzhilian.com/chanye/2023-04-23/638754.html
友情提示:文章内容为作者个人观点,不代表本站立场且不构成任何建议,本站拥有对此声明的最终解释权。如果读者发现稿件侵权、失实、错误等问题,可联系我们处理
- 上一篇:生物类似药参照药及分析批次的选择
- 下一篇:返回列表
- 药品安全形势平稳可控 质量持续保持较高水平2023-04-23 11:02:15
- 生物类似药参照药及分析批次的选择2023-04-23 11:01:40
- 原料药出口上升24.04% 生化药进口增长超七成2023-04-23 11:01:22
- 欧莱雅中国逆势增长领跑市场 全新“5界”策略勾勒美的无界未来2023-04-23 10:59:51
- “CXO二哥”增收不增利 大股东减持连累股价 坚定看好CGT CDMO业务2023-04-23 10:59:28
-

 70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
70岁以上老人核酸检测费用多少 新规定明天起不做核酸了吗
2022-11-07
-

 梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
梅婷现任70岁老公曾剑个人资料(曾剑个人资料)
2022-09-08
-
烟台今天已封闭的小区 烟台现在封闭小区名单有哪些
2022-10-12 09:07:30
-
张家界桑植新娘吴梅婚纱照事件完整版 看女主出轨聊天内容视频
2022-11-11 14:27:00
-
无人售货机功能(无人自动售货机操作方法介绍)
2022-07-27 08:41:09
-
目前南岸区及江北封闭小区名单有哪些 看最新封控通告
2022-11-11 14:49:26
-
2022南宁封控小区名单表 南宁最新封闭小区名单2022年8月什么情况
2022-08-26 09:52:30
文章排行榜
- 周排名
- 月排名
- 1北京大学人民医院神经内科罕见病系列报导之三—— 北京大学人民医院首例患者接受伊奈利珠单抗治疗视神经脊髓炎(NMOSD)
- 2关爱血友病儿,健康茁壮成长—— 复旦大学附属儿科医院2023年世界血友病日暨血友病俱乐部活动顺利举行
- 3预防治疗 人人可及 ——2023年云南省世界血友病日纪念活动圆满落幕
- 4李红蓉教授:通络养生八字经为慢病防治开辟新途径!
- 5中国民族卫生协会重症代谢疾病分会“痛风基层慢病医联体临床培训中心”项目在江苏昆山启动
- 6淋巴水肿超显微淋巴静脉吻合术日前在成都七院完成首例
- 7应对变异、广谱多价,专家共话新冠病毒疫苗研发新进展
- 8“汇智·聚融·谋远” 赛赋医药创新药物研发生态圈论坛北京站圆满召开
- 9长月烬明带火蚌埠旅游热 景区开设网红打卡点
- 10AI+游戏即将迎来新浪潮?超参数科技发布GAEA技术系统,能让NPC自己过日子